Medicinski proizvodi
Uredba EU za medicinska sredstva (2017/745)
Uredba (EU) 2017/745
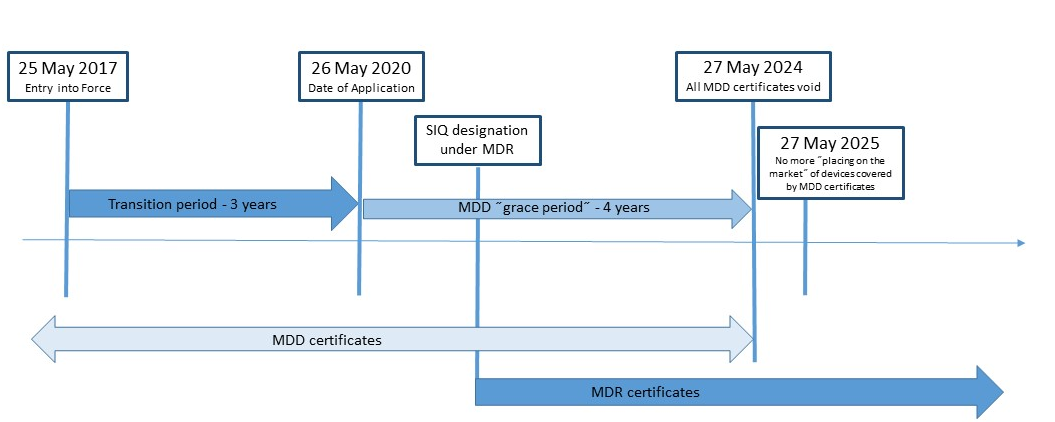
Nova Uredba (EU) za medicinska sredstva 2017/745 (MDR) objavljena je u Službenom listu Europske unije 5. svibnja 2017. i stupa na snagu 25. svibnja 2017. MDR (Medicinska regulativa) zamijenit će Direktivu o medicinskim sredstvima MDD 93/42/EEC i Direktivu o aktivnim implantabilnim medicinskim sredstvima (AIMD) 90/385/EGS. SIQ Ljubljana je u postupku dobivanja imenovanja po Uredbi (EU) 2017/745. Certifikati izdani u skladu s MDD po objavljivanju MDR (25. svibnja 2017) su važeći do kraja perioda navedenog u samom certifikatu, a koji ne prelazi pet (5) godina od datuma izdanja. Oni će postati nevažeći najkasnije 27. svibnja 2024.
Zašto imati certifikat?
Zakonodavstvo EU (Uredba MDR) o medicinskim sredstvima predviđa da proizvođači medicinskih sredstava svoje proizvode moraju označiti CE znakom prije nego što ih plasiraju (stave) na tržište EU. Time izjavljuju da je medicinsko sredstvo usuglašeno s propisima EU koji uređuju (reguliraju) područje medicinskih sredstava i potvrđuju da je njihovo medicinsko sredstvo sigurno i usuglašeno s propisima. Kada je medicinsko sredstvo klase Is, Im, Ir, IIa, IIb in III u postupak usuglašavanja sa zahtjevima regulative (MDR) mora biti uključen i ovlašteni organ (SIQ). Usuglašenost sa zahtjevima propisa EU koji se odnose na medicinska sredstva dokazuju se dodijeljenim EU certifikatom (EU Certificate).
Sustav upravljanja kvalitetom po ISO 13485 i Uredba (EU) 2017/745
ISO 13485 je harmonizirana norma kojim proizvođači medicinskih sredstava dokazuju usuglašenost sustava upravljanja kvalitetom sa zahtjevima uredbe MDR. Pored zahtjeva norme proizvođači medicinskih sredstava moraju poštovati i primjenjivati posebne zahtjeve koje propisuje uredba. Pri postupku ocjenjivanja usuglašenosti po Aneksu IX i Aneksu XI u dijelu A, preporučuje se da proizvođač ima uspostavljen sustav upravljanja po normi ISO 13485.
Certifikacija medicinskih sredstava po Uredbi (EU) 2017/745
Medicinska sredstva se mogu plasirati (staviti) na tržište EU i nositi CE oznaku ako ispunjavaju bitne zahtjeve uredbe (MDR). Medicinska sredstva se klasificiraju prema stupnju rizika na:
- klasa I – medicinska sredstva s niskom stopom rizika za korisnika
- klasa IIa – medicinska sredstva s većom stopom rizika za korisnika
- klasa IIb – medicinska sredstva s visokom stopom rizika za korisnika i
- klasa III – medicinska sredstva s najvišom stopom rizika za korisnika
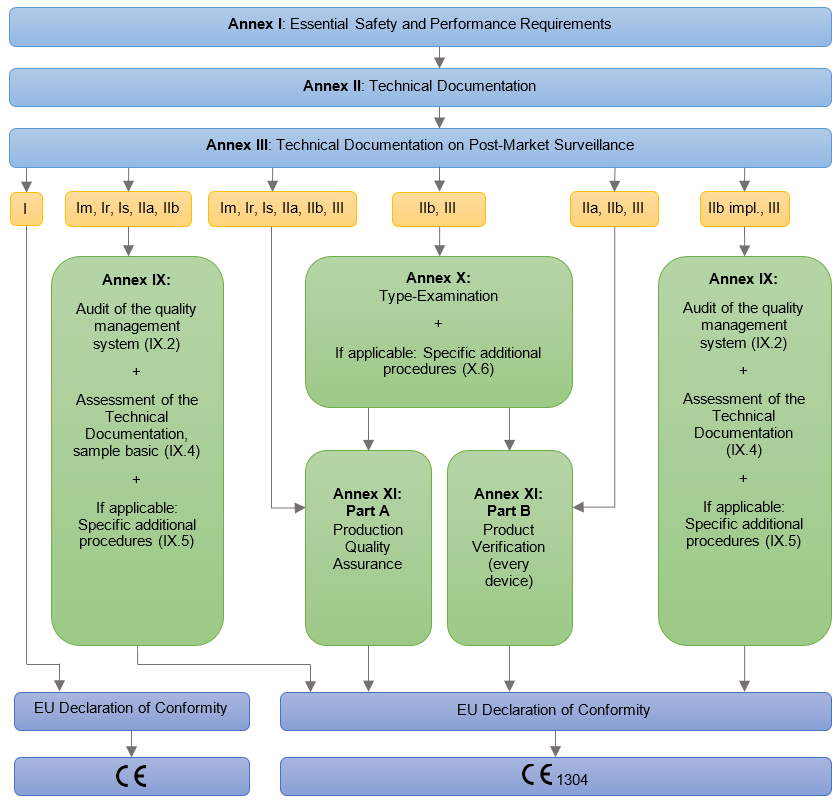
Postupak certifikacije obuhvaća provjeru dokumentacije /tehničke mape (tehničkog file) proizvoda, medicinskog sredstva i certifikacijske provjere. Preporučeno je da proizvođač medicinskog sredstva ima uspostavljen sustav upravljanja kvalitetom po normi ISO 13485. Provjera po medicinskoj uredbi, se može kombinirati s provjerom po normi ISO 13485. Po dodijeli EU certifikata i certifikata za ISO 13485 jednom godišnje redovnim nadzorom pojedinih dijelova sustava provjeravamo funkcioniranje sustava nakon treće godine provodimo recertifikacijsku (obnavljajuću) provjeru za ISO 13485. EU certifikat je važeći sve dok se godišnje dokazuje ispunjenost zahtjeva ISO 13485 i uredbe.
Glavni koraci u postupku dobivanja CE znaka
- Klasifikacija medicinskog sredstva
- Uspostavljanje kontakta s ovlaštenim tijelom za medicinska sredstva klasa Is, Im, Ir, IIa, IIb i III
- Izbor odgovarajućeg postupka ocjenjivanja usuglašenosti (zavisno od klasifikacije medicinskog sredstva / klase i s tim povezanog stupnja rizika za korisnike kao i odluke samog proizvođača)
- Odluka o uspostavljanju sustava upravljanja kvalitetom po ISO 13485 za proizvođače medicinskih sredstava klasa Is, Im, Ir, IIa, IIb i III (osim postupka ocjenjivanja usuglašenosti po aneksu X i/ili aneksu XI u dijelu B)
- Ispunjavanje bitnih zahtjeva Uredbe MDR
- Priprema tehničke mape (tehničke dokumentacije) s EC izjavom o usuglašenosti (Aneksi II i III MDR)
- Ocjenjivanje usuglašenosti
- Stavljanje CE oznake na medicinska sredstva
Tehnička dokumentacija/Tehnička mapa
Proizvođač mora u postupku ocjenjivanja usuglašenosti izraditi tehničku dokumentaciju za medicinsko sredstvo / grupu medicinskih sredstava na osnovu koje se provjerava ispunjenost bitnih zahtjeva medicinske uredbe. Obvezni sadržaj tehničke dokumentacije je opredjeljenje prema Aneksu II i Aneksu III uredbe MDR. Tehničku dokumentaciju ocjenjuje ovlašteno tijelo, osim u slučaju medicinskih sredstava klase I, gdje to nije obavezno.
Ispitivanje električne i magnetne sigurnosti za aktivna medicinska sredstva
Proizvođači aktivnih medicinskih sredstava moraju u postupku ocjenjivanja usuglašenosti dokazivati poštovanje i primjenu općih zahtjeva i za električnu i magnetnu sigurnost. SIQ nudi (ima i) priznate i akreditirane ispitne laboratorije za testiranje (ispitivanje) određenih vrsta električnih medicinskih uređaja i opreme te ispitivanje elektromagnetne kompatibilnosti. Više o tome…
Kontakt
- SIQ Ljubljana
- Mašera – Spasićeva ulica 10
- SI-1000 Ljubljana
- Petra Domijan, dipl.ing.
- Stručni suradnik za sustave upravljanja
- Tel: +385 98 360 891
- domijan.petra@siq.si
Povezave
Zakon o medicinskih pripomočkih
Pravilnik o medicinskih pripomočkih
Evropska vodila po zakonodaji v zvezi z medicinskimi pripomočki
Pristojbine po uredbi (EU) 2017/745
Vprašalnik za certificiranje medicinskih pripomočkov po uredbi (EU) 2017/745
Javna agencija RS za zdravila in medicinske pripomočke